牛粪中潜在生物控制剂枯草芽孢杆菌QM3的分离和鉴定
摘要:在以前,生物控制剂与牦牛粪没有联系。这里描述的是从中国青海牦牛粪中分离出来的QM3菌株。体外捷康试验表明,该菌株能有效地抑制多种植物病原体的生长,特别是Alternaria solani病原体。根据表型、生理、生化和16Sr DNA的系统发育的研究,QM3菌株可以界定为一种枯草芽孢杆菌。八种不同种类培养基的OD660和抑制作用表现出非常大的差异,差异度分别为0.006(P< 0.01)和0.003(P<0.01)。YPF-Ca培养基是根据OD660和抑制作用从八种不同的培养基中选择出来的。当温度不高于100℃时,不同热处理的粗取上清液表现的抗生活型在方差分析为5%水平上没有差异(P=0.54,P>0.05)。这些结果基本上与报道过的由芽孢杆菌产生的伊枯草菌素抗生素的抗热性相一致。这是第一次关于从牦牛粪中分离枯草芽孢杆菌的报道。
关键词:生物防控;牦牛粪;枯草芽孢杆菌;16SrDNA;拮抗作用
引言:病原微生物影响植物的健康对于粮食生产和全球生态系统的稳定时一项重大而长期的威胁。生物防控已被描述为无毒害的战略以减少由植物病原体造成的农作物危害。(Bagnascoetal.1998)对于控制植物病原体,以生物目的的微生物使用已成为一个有效地替代物。有许多生物防治配方的例子都应用细菌或真菌菌株(Bernaletal.2002)。由于细菌产品的遗传和生化分析以及大规模生产比这些真菌更容易些,所以细菌防控的发展将具有很大的潜力。
同样的细菌控制剂,农杆菌,假单胞菌,产碱杆菌属,链霉菌等都已有报道(Skoda 2000)。但假单胞菌作为细菌控制剂和一些已出版的审查和深入研究报告的候选人已有相当久的历史,并在应用芽孢杆菌的最新进展中得到强调。枯草菌能产伊枯草菌素A和表面活性素的肽类抗生素作为生物控制剂,由于其具有抑制和拮抗植物病原菌的活性而具有重大意义。(Balls et al.2004)
大多数芽孢杆菌已经从土壤、受感染的植物、根际、叶际和植物内生菌中分离。从后三种样品的分离,对细菌和一般称为植物生长促进菌(PGPB)有利(Han et al.2005)。PGPB介导的广泛认可的生控机制是对一个小生态或一个底物的竞争,产生抑制物质和诱导寄主植物对广谱的病原体和(或)生物胁迫产生系统抗性(Compantetal.2005)。
近年来,运用传统作物种植模式以保持农业和环境的可持续发展受到更大的关注。牛粪堆肥可能是有益自由生活细菌,比如用PGPB来保护植物免受植物病原体的侵害,这已被证明是非常有前途的。
然而,关于从牛粪中分离PGPB菌株以对植物病害进行生物控制或其他一些相关的物理过程都缺乏详细的资料。
在这项实验中,我们报告的是来自牦牛粪中的QM3菌株的分离和鉴定。调查它对多种植物体外真菌病原体的拮抗能力和拮抗物质的热稳定特性。通过这次研究我们将得到一种生控剂PGPB抑制植物病原菌的理论。这将为更成功的发展以利用更有利的微生物资源来保护作物为目的的战略提供重要的一步。
据作者所知,QM3菌株是第一次从牛粪中分离的对植物可能有促进生长作用,而且具有广谱抗病原菌的细菌。
材料和方法:
培养基和生长条件
细菌通常在35℃下在琼脂(NA)培养基(蛋白胨、10g,牛肉膏、3g,NaCl、5g,琼脂、15g,PH 7.2-7.4)上生长。植物病原菌由中国陕西西安微生物教研室,太谷路陕西农业大学农学院植物病理学系提供。真菌在30℃条件下生长于马铃薯琼脂糖平板上,用无菌水保持室温。
分离细菌
杆菌从中国青海的一个健康的牦牛的粪中提取。所有的实验程序,类似于Y和L(2007)的方法,在无菌环境下进行。筛选干牛粪(5g)和无菌水(45ml)混合并用磁力搅拌器搅拌30min,进行一系列稀释。然后涂布于NA平板培养基上。平板在35℃下培养20h以获得单菌落。从每个平板上挑取单菌落在其他新平板上划条纹来检验它的纯度。然后获得纯的菌株,检测每个菌株在体外对病原菌的拮抗能力。在体外筛选拮抗细菌。
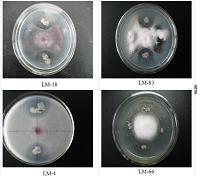
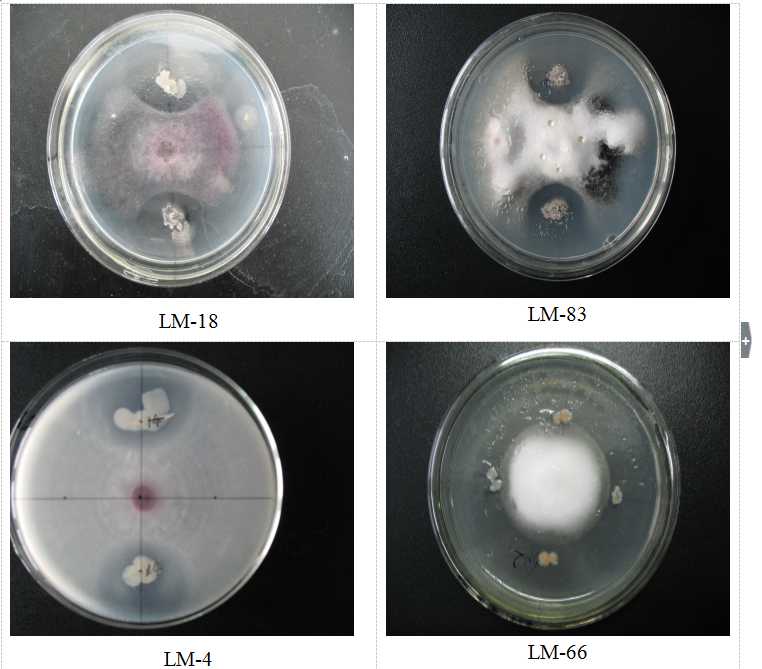
所有的菌株都要检测他们对链格孢菌,Botrytiscinerea,Fulviafulva,Colleto trichumgossypii Soutllw,Fusariumoxysporum f.sp.niveum, Fusariumoxysporum f.sp. cucumerinum Owen,Fusariumgraminearum, Fusariumoxysporum f.sp.vasinfectum,Bo tyosphaeriaberengeriana deNot,Alternariaalternata和未鉴定的菌株(UIP)的抑制能力。这个拮抗实验按Bagnasco等(1998)描述的进行。对他的修改如下:从一个在30℃下培养2天的生长有病原菌培养物的PDA平板的尖端取得一个1.0c m的圆盘,转移到另一个新鲜PDA平板的中央。细菌菌株接种在新平板的边缘。平板在30℃下培养5d,菌株对真菌生长的抑制作用按照抑菌圈的形成而定。具有持续抑制作用的抑菌圈进一步评估。
形态和生化特征
两者的形态和显微镜下的特征的观察用光学显微镜进行。革兰氏反应的测定按照标准的微生物程序(rdtetal.1994)。孢子的形成是由于孔雀是绿色细胞不适应在琼脂上生长(Gerhardtetal.1994)。细胞大小的观察用电子显微镜(S570,HITA CHI,Japan)。
碳源包括葡萄糖、甘露糖和D-半乳糖,经过过滤消毒添加到高压灭菌的培养基上,终浓度为0.2%(w/v)。菌株在35℃下在150rew/min的摇床上培育24h,在同一培养基上传代30次。基本培养基都用于对照。所有试验都做了一式三份。
过氧化氢酶和氧化酶活性试验和吲哚及H2S的形成、柠檬酸的利用、VP试验、明矾枫香试验,以及淀粉和酪蛋白水解试验是按标准的微生物程序进行的(Gerhardtetal.1994)。反硝化和亚硝酸盐减少的测定用斯塔尼尔等方法(1996年)。
16SrDNA的扩增及序列分析
使用进口试剂盒进行基因组DNA提取。根据前面描述的方法,准备一些具有普遍性的引物。(F等1995)上游引物(原名27F):5-AGA GTT TGA TCA TGG CTC AG-3;下游引物(命名为1492R),5-TAC GGY TAC CTT GTT ACG ACT T-3,相应的位置分别是杆菌16SrDNA的8-27和1471-1492。近1500bp的16SrDNA的产品是通过PCR核酸样品扩增的。PCR反应混合物(30μl)包含有1μl模板,1μl引物,15μl2-pufPCR Master Mix(KP201-01,Tiangen Biotech CO,LED,China),然后用去离子水调节到30μl。2-pufPCR Master Mix组成成份为:0.1Upuf聚合物,各种dNTP500μl,50mMTrisHCl(pH8.7), 20mMKCl,4mMMgCl2.该聚合酶链式反应在PTC-100Peltier Thermal Cycler (Bio-Rad Laboratories ,USA)中完成,开始运行时在95℃下进行30min,然后进行30次循环,95℃下为50s,52℃下为50s,在72℃下为2min,然后最后的扩增在72℃进行10min。
加载10μl的PCR扩增DNA产物到1.5%(w/v)的琼脂糖凝胶进行电泳分析,,琼脂糖凝胶包含有溴化乙锭,终浓度为0.5μl/ml,在用阿尔法成像系统对凝胶数字化扫描之前,凝胶在恒定电压为70v的条件下进行30min的电泳分析。PCR产物根据制造商的说明应用Qiaquick DNA凝胶纯化试剂盒进行纯化,然后用PGM-T载体(VT102-01,TiangenBiotechCO.,LED,China)把产物引入到大肠杆菌DH5α中。含有一个适当大小的独特插入序列的质粒得纯化在QIAprep自旋minprep试剂盒(Qiagen公司,希尔登,德国)中完成,并在上海生工生物工程技术服务有限公司(中国)使用ABI的DNA测序的DNA自动测序仪的棱镜3730(AppliedBiotech公司,美国)的检测。
系统发生树通过MAGA3.1软件(www.megasoftware..bysj1.com)应用临近连接法构建。通过1000组数据的引导分析来评价该树的聚类稳定性(Han 2005)。
培养基的选择和QM3菌株生长的研究
用八种不同的液体培养基用来研究拮抗物质的生产水平和增长质量。这些培养基是:YPGI(酵母提取物1g/l,蛋白胨10g/l;葡萄糖10g/l,PH7.0),YPG1-Ca(酵母提取物1g/l,蛋白胨10g/;葡萄糖10g/l,CaCl2-2H2O5g/l,PH7.0),YPM(酵母提取物1g/l,蛋白胨10g/l;甘露糖10g/l,PH7.0),YPM-Ca(酵母提取物1g/l,蛋白胨10g/l;甘露糖10g/l,CaCl2H2O 5g/l,PH7.0),YPF(酵母提取物1g/l,蛋白胨10g/l;D-果糖10g/l;PH7.0),YPF-Ga(酵母提取物1g/l,蛋白胨10g/l;D-半乳糖10g/l;CaCl2 H2O5g/l,PH7.0),和YPGa(酵母提取物1g/l,蛋白胨10g/l;D-半乳糖10g/l;PH7.0)和YPGa-Ca(酵母提取物1g/l; 蛋白胨10g/l;D-半乳糖10g/l;CaCl2 2H2O 5g/l;pH7.0)。最佳培养基是根据平板上病原菌的生长抑制区的大小选择的,然后用光密度为660nm来测量其生长。在35℃100rew/min的摇床上培育40h后再进行所有试验。当OD660测得后,培养基在10000g离心机离心10min。小的碎片被抛弃。原上清液通过622μm的滤过膜进行过滤,然后在40℃下保存。所有试验一式三份。
热处理对抗菌活性的影响
取上面提到的YFP-Ca培养基的原上清液培养物1.5ml分装到无菌的EPP试管中。试管做如下处理:(a)保持在25℃,(b)水浴60℃加热20min,(c)沸水浴20min,(d)高压蒸汽灭菌(121℃)20min。取200ml的热处理试样,测试其对A的抑制活性。所有试验一式三份。
统计分析
应用SPSS13.0软件进行数据分析。非参数测验是在1%水平,方差测验在5%水平。
结果:微生物的分离以及体外拮抗作用的评价。
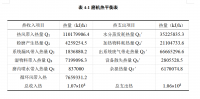
从中国青海牦牛粪中得到的9种分离物都对PDA平板上的真菌有体外拮抗作用。其中两种是放线菌,其他的都是细菌。然而,9种菌株对11种植物病原菌的体外拮抗作用不同(Table 1)。QM3菌株对11种植物病原菌的抑制作用比其他菌株表现的更强。QM3菌株被选定作进一步研究。
QM3菌株的表型特征
细胞为革兰氏阳性,略微弯曲的杆状,单或成对,大小为0.5-1.0μm×1.5-2.0 μm(Fig.1)。传播中形成椭圆形孢子,游动的严格的好氧细菌。菌落干燥折叠,不透明,边缘不规则,扩散呈灰色。
生化特性:QM3菌株能在45℃,PH5.7的培养液中生长,在65℃时不能生长。而且在不同盐浓度(2%、5%、7%、10%)下能发酵多种碳水化合物,包括葡萄糖(仅生成酸),甘露糖,D-半乳糖和柠檬酸。但不能产生吲哚。可以进行下面的反应:淀粉和酪蛋白的水解,明胶液化,VP试验(PH7.83),过氧化氢酶和氧化,产生H2S,利用柠檬酸,反硝化作用和吸收亚硝酸盐。
16SrDNA序列和系统发育分析
我们利用16SrDNA基因基本序列来鉴定筛选QM3。全长(约1.5kb的片段)的16SrDNA基因被扩增,纯化。导入大肠杆菌DH52。被选择在LB培养基上培育的白色菌落含有氨苄青霉素(100ug/ml)。在PGM-T质粒被纯化和引物扩增后,筛选一个大小合适的特异插入序列。用1ml阳性菌落进行DNA序列分析。
QM3菌株的完整16SrDNA被测序,而且可在GenBank中的序列号为EU221258。进化树(Fig.3)是在1460bp的16SrDNA序列一致性的基础上建立的。根据多序列比对和序列比对编辑器程序的序列分析,表明枯草的同源性高达99.99%(登录号:DQ993674)。与乙短小芽孢杆菌同源性为96.75%(登录号:AY373359)和其他的在1460位点同源性为97.8%-99.78%。除了内生芽孢杆菌(AF399911)的1280位点。
最佳培养基的选择:
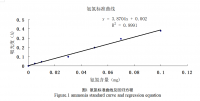
发酵过程表明,对于抗生素的生产来说,甘露糖是比葡萄糖刚好的碳源。QM3菌株培养基在八种不同的培养基上培育40h;他们的OD660和拮抗活性表现出非常大的差异(Table2)。Kruskal-Wallis实验表明,OD660和拮抗作用的渐进意义的评价值分别为:0.003(P<0.01)和0.006(P〈0.01)。尽管在XPGa-Ca培养基上QM3菌株的OD660是最高,但是在培育40h后,他的抑制作用是最低的(Fig.4)。应用性的YPF-Ca培养基的OD660和抑制作用非常的一致。
抗生素的热稳定性
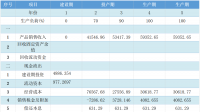
抗生素的热稳定性的结果显示在表格3中。在温度不高于100℃时,不同的热处理不影响原上清液的抗菌活性。不同处理的等分抑制区域大小相同,作为对照的未处理的等分也相同。但由于高压灭菌,抑制区消失。利用上边提到的其他病原菌作为目标得到相似的结果(未显示数据)。
讨论:牛粪中有大量的微生物。根据我们分离的结果,大肠杆菌是牛粪中主要的微生物之一。在琼脂上生长的QM3菌株的菌落数目常常是最多的,甚至稀释度上升到10倍以上。这表明牦牛粪中高含量的有机化合物提供了潜在的生物资源。在过去有许多例子表明,直接使用牛粪堆肥热处理材料以促进作物的生长和防止植物立枯病。据我们所知,这是第一次关于从牛粪中得到的能有效的抑制病原菌的分离物的报道。在区域清楚的琼脂平板上进行生物实验,常常用于研究QM3代谢产物对11种病原菌的抑菌活性。抑制区表明了,QM3能产出有效地抗生素。因为抗生素抑制真核生物的生长,枯草合成的其他枯草菌素有相同的情况,这些结果是很有意义的。根据我们的结果,由QM3产生的抗生素具有杀菌活性,可能有杀死真菌的活性。伊枯草菌素具有增加目的微生物细胞膜的渗透性是由于在细胞膜上形成了离子通道。在我们的工作中,在体外琼脂平板的实验表明QM3和原上清液都能抑制由A引起的病害。我们发现未经0.22μm滤过膜过滤的上清液在PDA琼脂上能产生扩大的清晰点的区域。这些结果表明了对病原菌的抑制机制,包括空间和营养物的竞争,以及产生抗生素代谢物质(没有被过滤)。初始结果表明,菌株产生了类抗生素化合物,但这些代谢物在病害抑制中的作用需要进一步研究。一些细菌特征,例如快速生长繁殖,对区域养料和土壤资源的竞争,将影响拮抗反应。此外,在自然条件下,细菌可能产生化合物来抑制真菌,在培养基中不能产生。关于抑制由A.solani引起的病害和上面提到的其他病害的温室和大田试验是有必要的。在蔬菜(辣椒、黄瓜、和西瓜)中应用QM3菌株的有益影响实验正在进行中。
16SrDNA序列允许在物种水平上的鉴定,准确度是97%-100%。将该序列与Genbank数据库中的序列比对。在我们的工作中,根据其形态、生理生化特性的基础上,以及他的16SrDNA分析,QM3被定为枯草芽孢杆菌菌株。
我们发现当QM3在YPM和YPF培养基上培养时,抗生素的合成增加。这两种培养基包含有甘露醇、果糖,用来代替葡萄糖作为碳源。这符合Besson(1987)等的观点,他报道对于合成枯燥芽孢杆菌素A来说,甘露醇、果糖和蔗糖是比葡萄糖更好的碳源。有个常规机制,叫做分解代谢阻遏,用来使营养利用效率最大化和控制其他代谢途径。有一个分解代谢阻遏监管机制,它他通过调节细胞中碳和能量来源的新陈代谢,以最大限度地提高养分的利用率和控制其他代谢过程(Bernal et al.2002年)。这是一个证据充分的事实,葡萄糖促进参与在较低速率的碳水化合物分解代谢的酶的抑制作用。因此,建立了有层次结构的碳和能源的利用。根据这一点,次级代谢产物的合成直接或间接的受到葡萄糖分解抑制作用的影响。
根据Bernal等(2002)的研究,0.5%水平的钙离子对CPM培养基上培养的突变菌M40的抗生素产量有重大影响。在Lactococcus lactisIO-1培养基上观察到了类似的作用,在培养基中添加Ca2+引起抗生素乳酸链球菌素Z产量的巨大增长(1996)。然而,Besson等(1987)观察到了相反的作用,他报道在培养枯草菌的培养基中添加CaCl2完全抑制了伊枯草菌素的产生。我们研究的一些部分和Besson等(1987)的报道和另外的恝效应影响一致。Ca2+在0.5%水平上没有引起YPG1和YPF培养基中抗生素的显著增加(P>0.05),在YPG1和YPF培养基中添加相同浓度的Ca2+导致抑制作用的显著降低(P>0.05)。增加的原因是:Ca2+改变了芽孢杆菌细胞膜的透性,阻止了抗生素成分的排泄。然而,同样的作者证明了Ca2+和Mn2+促进伊枯草菌素A和L的沉淀,在其排泄到培养基后(Besson and Michel 1991)。
在我们的试验中,由于过高的Ca2+浓度使芽孢杆菌QM3的细胞壁的透性受到抑制,从而导致培养基中抗生素的浓度减少,这一点与Besson的观点一致。我们推测细胞壁增加微生物环境中Ca2+浓度的能力在最后阶段的不良作用发挥重要作用。另一方面,不同的碳源将导致不同的结果。关于这一点,我们推测将不同培养物的代谢途径考虑在内则有待进一步的研究。
对BQM3培养物的上清液的不同热处理表明,拮抗代谢的耐热性。在A.solani培养基和其他10种病原菌培养盘上的生长抑制区对所有上清液都是一样的受到独立的热处理,除了上边的应用的是蒸压处理。这些结果与报道的有芽孢杆菌产生的伊枯草菌素的耐热性是基本一致的。关于包括伊枯草菌素家族在内的BQM3生产的抗生素的化学结构的确定需要进一步研究。
另一方面,抗生素生产的动力学、最优培养基的设计以及产品的回收需要进一步的研究。一旦这一原理被阐明,基因工程可以通过克隆像根瘤菌或其他成员的根际生物的生物合成基因来完成。